【冠元穎粒の高血糖改善作用】
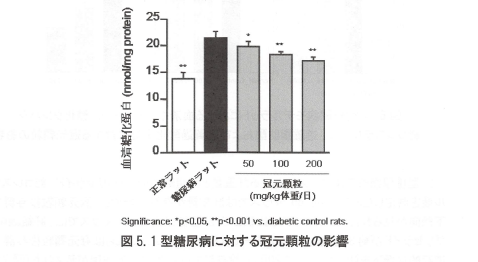
正常ラットにストレプトゾトシンを投与して1型糖尿病ラットを作成し、冠元穎粒20日間投与による影響を調べた。その結果、ストレプトゾトシン投与ラットにおいて、血清中糖化タンパク(AGE)の増加が認められた。冠元穎粒投与はこのAGEの増加を抑制した。このことから冠元穎粒が、持続的な高血糖状態により産生される糖化蛋白を有意に改善し、1型糖尿病における酸化的ストレスを抑制することが考えられた、このことから、メタボリック症候群における動脈硬化進展因子の抑制作用が示唆された(図5)。
図5.1型糖尿病に対する冠元穎粒の影響
【2型糖尿病による高血圧、脂質代謝異常に対する冠元穎粒の影響】
2型糖尿病モデルマウス(db/dbマウス)を用いて、高血糖および抗血糖によって起こる高血圧、脂質代謝異常に対する冠元穎粒の作用を検討した。db/dbマウスは3から4週齢にかけて肥満症状を呈し、4から8週齢で血糖値が上昇する2型糖尿病モデルマウスである(12)。正常マウスと糖尿病モデルマウスを8週間予備飼育した後、冠元穎粒を100,200mg/kgの投与量で5週間連日経口投与した。
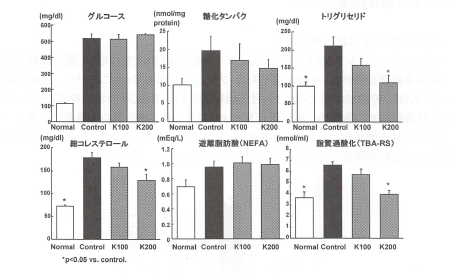
13週齢マウスの血清中パラメーターを測定した結果(図6)、正常マウスと比較して、2型糖尿病マウスでは血糖値、糖化タンパク、トリグリセリド、総コレステロール遊離脂肪酸および過酸化脂質の上昇が認められた。冠元穎粒の投与後、血糖値に変化はなかったが、トリグリセリド、総コレステロールは200mg投与群で有意に低下した。また、糖化タンパクは冠元穎粒投与群で低下傾向を示した。遊離脂肪酸に変化は認められなかったものの、脂質過酸化レベルは200mg投与群において有意に低下した。
図6.2型糖尿病モデルラットにおける血清中グルコース、糖化タンパク、
総コレステロール、遊離脂肪酸および脂質過酸化上昇に対する冠元穎粒の影響
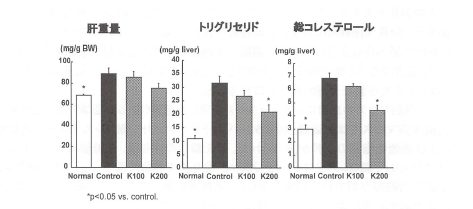
2型糖尿病モデルマウスにおける肝重量と肝組織中のトリルリセライド、総コレステロール値を測定したところ、db/dbマウスでは肝重量が有意に増加し、冠元穎粒投与群では低下傾向が見られた。正常マウスと比較して2型糖尿病モデルマウスでは、肝組織中のトリグリセライドが約3倍、総コレステロールは約2倍増加し、これらは冠元穎粒投与群で濃度依存的な低下を認めた。とくに200mg投与群では有意な低下作用が示された(図7)。
図7.2型糖尿病モデルマウス肝の肝重量、トリグリセリドおよび
総コレステロールに対する冠元穎粒の影響
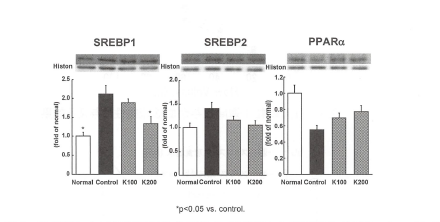
冠元穎粒は肝組織中のトリグリセリドと総コレステロールを低下作用を示したことから、肝組織中の脂質合成に関与する転写活性化因子のSREBP1とSREBP2、PPARaのタンパク発現量をウェスタンプロット法で解析した。SREBP1は脂肪酸合成関連遺伝子と、SREBP2はコレステロール合成関連遺伝子の発現調節をすることにより、脂質代謝を調節する(13-15)。一方、PPARaは肝臓における脂肪酸のβ酸化系酵素の誘導を促進し、血清トリグリセリドを低下させることが知られている。
SREBP1は正常マウスに比べ、2型糖尿病モデルマウス群において増加を示したが、冠元穎粒投与群では低下し、200mg投与群では有意差が認められた。SREBP2は冠元穎粒投与により、低下傾向を示した。一方、PPARaの発現量は、正常マウスと比較して
2型糖尿病モデルマウスでは低下が認められ、冠元穎粒投与群では増加傾向を認めた(図8)。
図8.肝組織における転写活性化因子のSREBP1とSREBP2、PPARaタンパクのウェスタンプロット解析
【冠元穎粒の高血圧(血管,血流)改善作用】
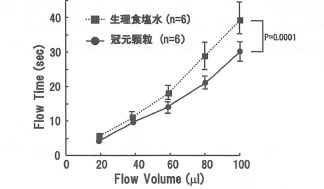
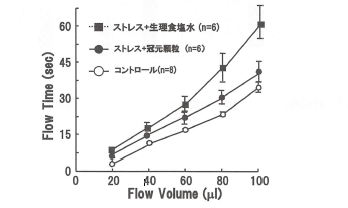
正常ラットに生理食塩水あるいは冠元穎粒を1週間投与後、MicroChannel FIow Analyzer (MC-FAN)を用いて血液通過速度を算出した。その結果、冠元穎粒の投与により、血液流出速度の有意な増加が認められた(図9)。さらに、外的刺激(ストレス)を与えることによりホルモンや自律神経活動の変化を介して血液流動性が低下することから、ストレス負荷ラット対する冠元穎粒の効果を検討したところ、有意差は認められなかったが血液流動性低下に対して軽減作用を示した(図10)。
図9.冠元穎粒1週間投与が血液流動性に与える効果
図’10 ストレスによる血液流動性低下に対する冠元穎粒の効果
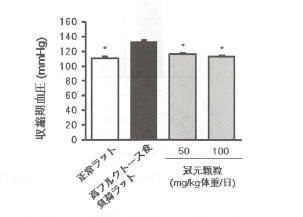
一方、高フルクトース食を負荷したメタボリック症候群モデルラットを用い、冠元穎粒投
与による影響を検討した。高フルクトース食で上昇した収縮期血圧に対して、冠元穎粒は
有意な低下作用を示した(図11)。
図11.血圧上昇に対する冠元穎粒の効果
【冠元穎粒の脂質代謝異常改善作用】
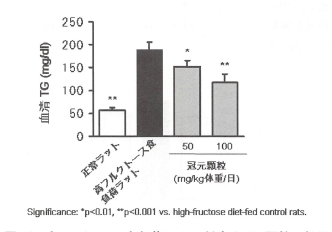
正常ラットに高コレステロール食を負荷したラットに、冠元穎粒を20日間同時投与によって血清HDLコレステロール値に対して、冠元穎粒の投与は、濃度依存的に改善作用を示した(図12)。さらに、高フルクトース食を負荷したラットを用いた場合、冠元穎粒は高フルクトースによって著しく増加した血清TG値を有意に抑制した(図13)。
図12.高コレステロール食負荷ラットに対する冠元穎粒
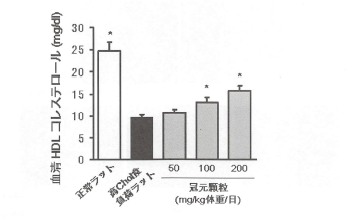
図13.高フルクトース食負荷ラットに対する冠元穎粒の効果
糖尿病において、慢性高血糖により全身の多くの組織・臓器でタンパクの糖化反応やミトコンドリアの電子伝達系が活性化され,酸化ストレスが増加することが報告されている(‘7,18)。最も酸化的ストレスを受けやすい組織である腎臓の腎尿細管細胞LLC-PK,細胞を用いて、高血糖により誘導される酸化的ストレスに対する冠元穎粒の影響を検討した。5mMグルコースでは細胞の形態に影響は認められなかったが、30mMグルコース処置は上皮細胞の形態変化を誘導し、細胞増殖を抑制した(図14)。冠元穎粒添加はグルコースによる細胞形態変化および増殖阻害を濃度依存的に抑制した。
図14.高グルコース暴露による細胞形態変化に対する冠元穎粒の抑制効果細胞の形態変化は光学顕微鏡で観察した(倍率×200倍)。
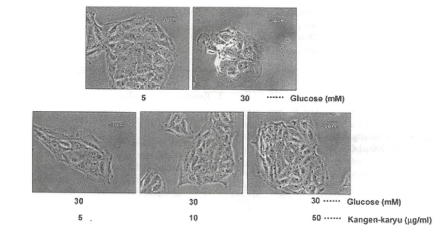
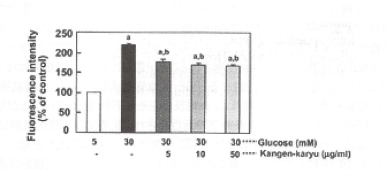
図15は高グルコース処置後の細胞内活性酸素産生を示している。5mMグルコースを
処置した細胞と比較して、30mMグルコースにより有意な細胞内活性酸素の増加が誘導さ
れた。冠元穎粒処置は活性酸素の産生を減少させた(図15)。
図15。細胞内活性酸素産生。データは平均士標準誤差を示す(n=6)
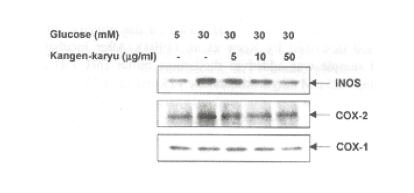
【誘導型一酸化窒素合成酵素およびシクロオキシゲナーゼに対する影響】
前炎症性酵素に関係するシクロオキシゲナーゼ(COXs)や誘導型一酸化窒素合成酵素(iNOS)は、糖尿病のような酸化的ストレスに関連した多くの慢性疾患の病態に関連することが知られている(19-21)。COXsにはCOX-1とCOX-2の2種類のアイソフオームがある。COX-1は種々の刺激により誘導されることはなく、常時細胞内に一定量存在している。一方COX-2は脳や腎臓などで恒常的に発現するがその他の組織では普段は発現が低く、炎症組織において発現が誘導されることから誘導型と称される。COX-2はサイトカインや増殖因子などの刺激により発現が誘導されることが知られている。炎症時にはCOX-2を介したPGE2″PGI2等の産生が冗進する。pGE2は血管透過性の冗進、血管拡張及び発痛に、pGI2は血管拡張及び発痛に関与し、炎症反応をそれぞれ進行させることが知られている。
iNOSは高グルコースのような条件下で活性化され、高濃度の一酸化窒素(NO)を誘導する。NOはスーパーオキサイドによりONOO-に変化し、細胞傷害を引き起こすことが報告されている。図16に示すように、高グルコースはiNOSとCOX-2の発現を促進した。冠元穎粒はこれらの発現を明らかに抑制した。
図16. iNOSとCOX-2の高グルコースによる発現増加と冠元穎粒による抑制作用のウェスタンプロット解析